Métodos en Taxonomía y
Nomenclatura Zoológica
Origen de la Taxonomía.
El colocar nombre a las especies de animales y plantas
y a los grupos principales de éstos se pierde en la prehistoria,
estando estrechamente unido al origen del lenguaje. Sin embargo, los primeros
intentos de organizar sistemáticamente la naturaleza son mucho
más modernos y nacen con las primeras civilizaciones. Pero no es
hasta el siglo XVIII de nuestra era cuando los trabajos gigantescos
de Carolus Linnaeus sentaron las bases de la moderna sistemática
taxonómica.
Originalmente la taxonomía fue concebida como
un intento de “clasificación” que permitiera ordenar
la obra de la naturaleza como un gran “Sistema Natural”,
 por lo cual se le conoce también como “Sistemática”.
Pero con la consolidación de los principios de la evolución
de los seres vivos, a partir de la obra de Charles Darwin, la taxonomía
es mirada como una forma de representar las relaciones de parentesco entre
los seres vivos, actuales o extinguidos, como las puntas de las ramas de
un árbol cuyo tronco se extiende por cientos de millones de años.
por lo cual se le conoce también como “Sistemática”.
Pero con la consolidación de los principios de la evolución
de los seres vivos, a partir de la obra de Charles Darwin, la taxonomía
es mirada como una forma de representar las relaciones de parentesco entre
los seres vivos, actuales o extinguidos, como las puntas de las ramas de
un árbol cuyo tronco se extiende por cientos de millones de años.
Taxones
Se llama taxón a los diferentes grupos en los cuales
se intenta clasificar a los seres vivos. Pero el problema reside en que
estos “taxones” no existen realmente en la naturaleza, con
la dudosa excepción de las especies. En realidad los que existen
son individuos y poblaciones.
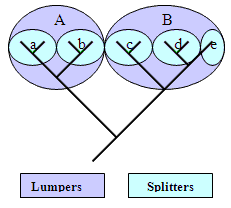
Algunos especialistas prefieren tener muchos grupos, cada uno bien definido.
Son conocidos como “Splitters”. Otros, a los que se los llama
“Lumpers” prefieren agrupar todas las especies relacionadas
en grandes grupos. Así por ejemplo, la familia Coccinellidae
puede incluir entre seis o alrededor de veinte subfamilias, según
los autores.
Taxonomia y Filogenética
Hoy en día se busca que los grupos taxonómicos
representen a todos los descendientes de una única especie ancestral.
Así, se presume que todos los Coleópteros
descienden de una sola especie que ocupo los bosques del período
Pérmico hace 290 millones de años, y los Coccinellidae
descienden de una especie que durante el período Cretaceo eligió
el camino de especializarse en predar sobre algunos Hemípteros
primitivos.
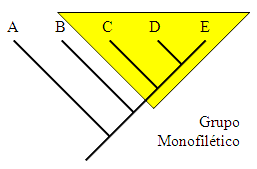 Grupo
monofilético: es aquel que comprende todos los descendientes
de un antecesor común. El género Eriopis,
en su actual composición, es probablemente un grupo monofilético. Grupo
monofilético: es aquel que comprende todos los descendientes
de un antecesor común. El género Eriopis,
en su actual composición, es probablemente un grupo monofilético.
Grupo parafilético: es un grupo
que contiene solo parte de los descendientes de un antecesor común.
La subfamilia Coccinellinae es un grupo de esta naturaleza,
ya que la subfamilia Epilachninae probablemente es un
grupo especializado derivado de esta misma subfamilia.
Algunos autores usan el término holofilético
para denominar lo que aqui se denomina monofilético,
mientras agrupan en el término monofoletico para
los taxones que representan descendientes de un único antecesor.
es decir, incluyendo los grupos parafiléticos.
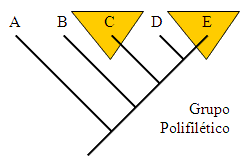 Grupo
polifilético: Un grupo en el cual se han mezclado especies
provenientes de distintos antecesores originales, y que se han agrupado
por convergencia adaptativa. El género Cycloneda
como se lo conoce hoy es probablemente polifilético, ya
que los autores incluyeron en el muchas especies no relacionadas, pero
que compartían su apariencia general. Grupo
polifilético: Un grupo en el cual se han mezclado especies
provenientes de distintos antecesores originales, y que se han agrupado
por convergencia adaptativa. El género Cycloneda
como se lo conoce hoy es probablemente polifilético, ya
que los autores incluyeron en el muchas especies no relacionadas, pero
que compartían su apariencia general.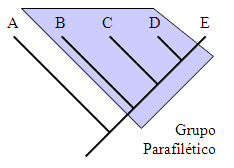
Aunque la taxonomía persigue
que los grupos definidos sean siempre monofiléticos,
esto no siempre se logra. Limitaciones en la cantidad de grupos a definir
y tradiciones nomenclaturales recomiendan a veces mantener estas separaciones
(por ejemplo, los reptiles son un grupo parafilético,
ya que no contienen a las aves, que es un grupo derivados de ellos)
Algunas Técnicas en Taxonomía
Las especies actualmente presentes en la tierra tienen
una historia que nos gustaría poder seguir a través de conocer
sus antepasados comunes. En cualquier grupo de familias, géneros
o especies relacionadas nos gustaría poder responder a la pregunta
¿cuáles están más emparentadas entre sí?
La reconstrucción del árbol filogenético
de un grupo de especies es una importante contribución a la comprensión
de estas. Nos dice como evolucionaron, que características dieron
origen a las principales divergencias y como se adaptaron a lo largo de
su historia evolutiva.
Análisis Cladístico
El análisis cladístico proporciona una metodología
que nos permite, con apoyo de herramientas matemáticas, establecer
un diagrama que representa en una forma sistemática las relaciones
entre las especies, derivándolas desde un antecesor común.
Se basa en el postulado conocido como “Parsimonia”, el cual
establece que la hipótesis que requiere menos supuestos es la más
aceptable. Los supuestos del análisis cladístico se relacionan
con la cantidad de mutaciones requeridas para alcanzar el estado actual
a partir de un estado primitivo representado por un grupo externo. Es
hoy ampliamente usado por todos aquellos que trabajan en filogenia.
Taxonomía Numérica
o Fenética
Esta técnica fue usada por Hiroyuki Sasaji, en
los años 60, para estudiar las relaciones entre las especies de
Coccinellidae a nivel mundial. Él ocupo
alrededor de un centenar de caracteres y las midió en especies
de muchas tribus diferentes.
La taxonomía numérica,
al igual que el análisis cladístico,
se basa en la similitud de las características del las especies.
Sin embargo no integra en el análisis la filogenia de estas, es
decir, de su evolución a partir de un antecesor común. En
tal sentido, su enfoque más simple ha sido abandonado por el análisis
cladístico.
La taxonomía hoy día está empezando
a apoyarse fuertemente en el análisis de ADN y enzimas de
las especies a fin de encontrar las distancias entre las especies. Esto
tiene dos ventajas muy importantes: como los cambios del ADN se generan
a cierta velocidad más o menos constante, se puede postular la
antiguedad de un antecesor común entre especies con bastante precisión.
Por otro lado, como se puede analizar poblaciones en lugares geográficos
diferentes, se puede entender mejor los procesos de distribución
geográfica actual y entender los procesos de dispersión.
Biogeografía
Desde Darwin, los científicos han intentado explicar
como las especies están distribuidas sobre la tierra. Wallace,
quien por primera vez hizo una separación de las grandes zonas
biogeográficas del planeta ya en el siglo XIX, sentó
las bases de lo que se conoce como la teoría del dispersalismo,
en el cual se concibe que las especies se desarrollan en ciertos centros
de origen (que en distintas líneas de pensamiento han conocido
otros nombres como Areas Ancestrales o Centros de Dispersión),
y desde ahí se dispersaban hacia otros ambientes. En tiempos de
Wallace y hasta bien entrado el siglo XX no se conocía la
teoría de la deriva de loscontinentes, por los cual se postulaban
"puentes" que habrían unido a éstos en el pasado.
Una posición alternativa fue la planteada por el
concepto de vicarianza, que supone que los taxones se dispersan
sobre vastas áreas, y posteriormente sufren procesos de extinción
que aislan a poblaciones que dan origen a nuevos taxones.
Hoy en día se explora por teorías combinadas,
que asumen tanto la existencia de centros de dispersión de taxones
como la especiación por vicarianza. Distintas líneas de
pensamiento privilegian enfoques en que se se le dá más
peso a la taxonomía o a la geografía. Esta es una disciplina
en la cual se está lejos de alcanzar consensos. Ante la escasez
de evidencia fosil, las distintas posiciones son parcialmente especulativas.
Algunas Técnicas en Biogeografía
A pesar de los desacuerdos
mencionados, en los últimos años una serie de técnicas
han venido a mejorar la disponibilidad de herramienta de que disponen
los biólogos hoy en día:
Técnica de los trazos de distribución:
esta técnica, planteada originalmente por L. Croizat y modificada
por J. Morrone permite establecer las posibles vías mediante las
cuales un taxón se distribuyó a los largo de la geografia.
En términos muy simple consiste en crear trazos uniendo cada localidad
en que se encuentra el taxón con la más cercana. Los trazos
individuales que se superponen permiten establecer trazos generalizados,
que plantean las rutas generales de migración de las especies.
El Analisis Cladístico aplicado a localidades
es una técnica que permite plantear la cercania biologica entre
localidades, permitiendo tambien apoyar los estudios biogeográficos.
Nomenclatura Zoológica
La nomenclatura zoológica fue iniciada a partir
de 1758 cuando Carolus Linnaeus estableció el primero de los principios
en que ésta se basa: la denominación binominal de las especies
zoológicas.
Actualmente la nomenclatura zoológica esta basada
en el Código
Internacional de Nomenclatura Zoológica, publicado
por la “Comisión Internacional en Nomenclatura Zoológica”,
organismo derivado del “Congreso Internacional de Biología”.
Su última edición (cuarta) data del año 2000.
El código actualmente vigente cubre cerca de un
centenar de artículos, divididos en más de 500 acápites.
Aún así, quedan muchos casos no resueltos, los cuales son
permanentemente remitidos a la Comisión Internacional en
Nomenclatura Zoológica, organismo que sesiona
permanentemente emitiendo sus opiniones y dictámenes en sus publicaciones
oficiales.
Adicionalmente existen códigos diferentes para
los vegetales, virus y bacterias. Tal es así,
que un nombre de especie puede repetirse entre estos grupos sin violar
ninguna regla taxonómica.
Principios de Nomenclatura Zoológica
- Principio de denominación binominal:
toda especie zoológica debe nombrarse con dos nombres,
el género y la especie.
- Principio de Disponibilidad: establece
las condiciones para que un nombre esté disponible para una especie
u otro taxón, fundamentalmente asociado a que se haya publicado
en un medio válido. Desde 1995 se acepta el CD (Compact Disk)
como medio válido de publicación.
- Principio de Tipificación: establece
las condiciones que deben cumplir los ejemplares tipo que representan
una especie u otro taxón.
- Principio de Prioridad: establece cuando
un nombre tiene preferencia sobre otro y se basa fundamentalmente en
la antigüedad relativa de su publicación.
- Principio de Coordinación: establece
relaciones entre los nombres de géneros, tribus, familias y otros
taxones de nivel superior.
- Principio de Estabilidad: establece
excepciones basándose en respetar nombres que se han usado durante
muchos años, aún cuando sean inválidos desde otros
aspectos
Tipos
  Los
tipos corresponden a especímenes de un animal (insecto en este
caso) o bien una ilustración o fotografía, que se considera
material de referencia para la identificación de un nombre determinado,
el cual esta asociado a una descripción específica. El tipo
en el caso de un Coccinellidae corresponde a un ejemplar debidamente
etiquetado que se guarda preferentemente en una institución o museo,
pero existen muchos tipos que permanecen en colecciones particulares.
Los tipos son material de referencia obligado para los especialistas que
revisan una especie o un grupo. Desgraciadamente muchos de los tipos de
especies chilenas se encuentran en museos de Europa o Estados Unidos,
pero el Museo Nacional de Historia Natural de Santiago conserva una importante
colección de tipos de especies nacionales. Los
tipos corresponden a especímenes de un animal (insecto en este
caso) o bien una ilustración o fotografía, que se considera
material de referencia para la identificación de un nombre determinado,
el cual esta asociado a una descripción específica. El tipo
en el caso de un Coccinellidae corresponde a un ejemplar debidamente
etiquetado que se guarda preferentemente en una institución o museo,
pero existen muchos tipos que permanecen en colecciones particulares.
Los tipos son material de referencia obligado para los especialistas que
revisan una especie o un grupo. Desgraciadamente muchos de los tipos de
especies chilenas se encuentran en museos de Europa o Estados Unidos,
pero el Museo Nacional de Historia Natural de Santiago conserva una importante
colección de tipos de especies nacionales.
Por ejemplo, el tipo de Coccinella sanguinolenta
(hoy Neorhizobius sanguinolentus) descrita por P. Germain
en 1855, en los Anales de la Universidad de Chile de ese año, se
encuentra depositado en el Museo Nacional de Historia Natural de Santiago
(MNHN) bajo el número 2146 (se adjuntas fotos del tipo y una de
sus etiquetas).
Existen diferentes tipos, que se listan a continuación:
- Holotipo:
Corresponde al especímen único considerado como tipo de
especie o subespecie.
- Alotipo: Un segundo
ejemplar, de sexo contrario al del holotipo.
- Paratipo: Otros especímenes
utilizados en la descripción original, de cualquier sexo, y designados
por el autor.
- Síntipo: Especímen
de una serie tipo, cuando el autor no denominó un holotipo
específico sino que basó su descripción en un grupo
de especímenes.
- Lectotipo: Especímen
dentro de una serie tipo (sintipo) que a posteriori se nombra
como el tipo de la especie.
- Paralectótipo: Cualquier
otro sintipo de una serie en la que se ha designado un lectotipo.
- Neotipo: Espécimen
único que se nombra como tipo de una especie cuyos tipos originales
han sido perdidos.
- Homotipo: Espécimen
determinado por una autor diferente del original, que ha sido comparado
con el holotipo.
Hoy en día todo autor que describe una nueva especie
está obligado a especificar los tipos y a declarar en que institución
o colección quedan estos depositados. Es habitual que se coloquen
etiquetas especiales de color a los tipos, para su identificación
posterior.
Determinación o Identificación
 La identificación o determinación es un acto nomenclatural mediante el cual se establece un nombre de especie para un ejemplar dado. Esto es generalmente efectuado por un especialista, y queda documentado a través de una etiqueta de identificación que se monta en el mismo alfiler del ejemplar. La etiqueta de identificación lleva tres datos: La identificación o determinación es un acto nomenclatural mediante el cual se establece un nombre de especie para un ejemplar dado. Esto es generalmente efectuado por un especialista, y queda documentado a través de una etiqueta de identificación que se monta en el mismo alfiler del ejemplar. La etiqueta de identificación lleva tres datos:
- Nombre de la especie : Género + especie + autor (el autor se coloca entre parentesis cuando el autor lo describio en un género diferente)
- Nombre de identificador: persona que efectua la determinación
- Año: Año en que se efectua la identificación.
- Subespecie: En este caso se coloca "Género + especie + subespecie+ autor", ej. "Coleomegilla maculata limensis (Phil&Phil)"
- Género: Cuando se identifica el género pero se desconoce la especie se coloca "Genero + sp.", ej: "Coleomegilla sp."
- Especie nueva: Cuando el especialista esta seguro que se trata de una especie no descrita, se puede incluir "Genero + sp. nov. ", ej: "Eriopis sp. nov.".
- Especie afín: Si se desconoce la especie pero se sabe que es similar o afin a otra conocida, pero se esta seguro de que no es esa especie, se coloca "Genero + aff. + especie". Ejemplo: "Eriopis aff. minima Hoffman" indica una especie distinta de "minima", pero cercana.
- Especie a comparar: Cuando se determina la especie pero se requiere analisis adicional para confirmar la determinación, se coloca "Genero + cf. + especie". Ejemplo: "Eriopis cf. minima Hoffman" indica que probablemente se trate de "minima", pero se necesita confirmación.
Tal como se establece en el código, los nombres de Género, especie y subespecie deben ir con itálica y en minúscula, excepto la primera letra del género que va siempre en mayúscula.
Acrónimos de Colecciones.
Los ejemplares representados en este sitio pertenecen a diferentes colecciones que hicieron pestamos al autor. Las instituciones están representadas mediante un acrónimo o sigla corta. Estos mismos acrónimos suelen incluirse en los trabajos científicos cuando se incluyen listas de ejemplares.
Existen varias instituciones que manejan listas de acrónimos. Estas no son de uso obligatorio ni existe una institución que tenga la representación para ello. La lista del Bishop Museum ha conseguido erigirse como un estandar de facto, sin embargo muchos trabajos e instituciones no la siguen. Esto deriva en que la misma colección esté representada por distintos acrónimos en diferentes trabajos, por lo cual en cada trabajo es obligatorio incluir los acrónimos a usar. Tampoco está normado la cantidad de letras que deba tener cada acrónimo, sin embargo algunas listas promueven que sean de cuatro caracteres.
Lo recomendado es usar el acrónimo que es propuesto por la institución o persona propietaria de la colección, pero este no siempre está disponible. A continuación se incluye una lista de los acrónimos usados en el sitio web, aunque aun existen páginas no normalizadas.
CEUNP |
Colección Entomológica de la Universidad Nacional, sede Palmira, Palmira, Valle del Cauca,
Colombia. |
CPAA |
Colección particular de Alfonso Aguilera, Temuco, Chile |
CPAL |
Colección particular de Alfredo Lüer, Santiago, Chile. |
CPCA |
Colección particular de Carlos Aguilar, Asunción, Paraguay. |
CPCF |
Colección particular de Claudia Funes, Catamarca, Argentina. |
CPDP |
Colección particular de Diego Perla, Lima, Perú. |
CPFR |
Colección particular de Francisco Ramírez, Santiago, Chile. |
CPGG |
Colección particular de Guillermo González, Santiago, Chile. |
CPJM |
Colección particular de Jimmy Miró, Tumbes, Perú. |
CPMD |
Colección particular de Manuel Diéguez, Santiago, Chile. |
CPMG |
Colección particular de Marcelo Guerrero, Santiago, Chile. |
CPMF |
Colección particular de Marcos Ferrú, Iquique, Chile. |
CPRH |
Colección particular de Richard Honour, Santiago, Chile. |
CPRC |
Colección particular de Robert Constantin, Saint-Lo, France. |
CPSR |
Colección particular de Sergio Roitman, Santiago, Chile. |
CPUD |
Colección particular de Ulf Drechsel, Asunción, Paraguay, |
CTNI |
Colección Taxonómica Nacional "Luis María Murillo" Corpoica, C.l. Tibaitatá, Mosquera, Bogotá, Colombia |
DZUP |
Coleçao Entomologica Pe. Jesus Santiago Moure, Universidade Federal de Paraná. Curitiba, Brasil. |
ICN |
Universidad Nacional de Colombia, Insituto de Ciencias Naturales, Bogotá, Colombia |
IFML |
Instituto Miguel Lillo, Tucumán, Argentina (=IMLT) |
INBP |
Inventario Biológico Nacional, Museo Nacional de Historia Natural del Paraguay, Asuncion, Paraguay. |
JEBC |
Colección particular de Juan Enrique Barriga, Curicó, Chile (=CPJEB, CJEB). |
KUNHM |
Snow Entomological Collection, University of Kansas, USA (Zachary Falin). |
MLPA |
Museo de la Plata, La Plata, Buenos Aires, Argentina. |
MACN |
Museo Argentino de Ciencias Naturales “Bernardino Rivadavia”, Buenos Aires, Argentina. |
MECP |
Museo de Entomología, Corporación Colombiana de Investigación Agropecuaria, Centro de Investigación Palmira, Palmira, Valle del Cauca, Colombia. |
MEFLG |
Museo Entomológico Francisco Luis Gallego, Universidad Nacional de Colombia, Medellín, Colombia. |
MEUC |
Museo de Entomología de la Universidad de Chile, Santiago. |
MEUT |
Museo de Entomología de la Universidad Nacional de Tumbes, Tumbes, Perú (=MEUNT) |
MIZA |
Museo del Instituto de Zoología Francisco Fernández Yépes, Maracay, Araguá, Venezuela |
MJMO |
Museo Entomológoco "José M. Osorio" del decanato de Agronomía de la Universidad Centroccidental Lisandro Alvarado (UCLA), Lara, Venezuela |
MHNS |
Museo Nacional de Historia Natural, Santiago, Chile (Bishop Museum = MNNC, MNHN) |
MUSM |
Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, Lima, Perú. |
UALM |
Museo de Entomología Klaus Raven Büller, Universidad Nacional Agraria La Molina, Lima, Perú (=UNALM) |
USAM |
Universidad Nacional Santiago Antúnez de Mayolo, Ancash, Perú (Karina Vilca) |
UTPL |
Colección Entomologica Universidad Técnica Particular de Loja, Ecuador (Diego Marín) |
UTAR |
Colección Entomológica, Universidad de Tarapacá, Arica, Chile. |
UMCE |
Colección Entomológica. Departamento de Biología. Universidad Metropolitana de Ciencias de la Educación. |
UNAB |
Museo Entomológico Facultad de Agronomía, Universidad Nacional de Colombia, Sede Bogotá, Bogotá, Cundinamarca, Colombia. |
URMU |
Museo Nacional de Historia Natural, Montevideo, Uruguay. |
USAA |
Universidad Nacional San Antonio Abad, Cusco, Perú (=UNSAAC) |
USNM |
U.S. National Museum of Natural History, Smithsonian Institution, Washington, USA. |
Genitalia de Coccinellidae

En muchos casos para la correcta identificación de una especie se requiere extraer el aparato genital. A continuación se dan algunas recomendaciones para efectuar este proceso.
- Asignar un número y registrar todo el proceso en una libreta o cuaderno. Es importante si se están haciendo varias genitalias a la vez, que no se confundan. Para ello además de ir anotando se recortan varias etiquetas con el número y estas se mantienen siempre al lado de cada parte.
- Fotografiar el ejemplar y etiquetas de localidades (opcional). Una vez hecha la genitalia y remontado el ejemplar este no queda igual (pueden abrirse las alas, etc.), por lo tanto es importante conservar registro de cómo era el ejemplar.
- Desmontar el ejemplar (opcional) Solo para ejemplares montados con productos sintéticos (barniz de uñas, etc.) es necesario desmontarlo previamente. Si esta montado con productos solubles en agua (goma arábiga) se desmonta solo al ablandar. Productos alternativos para desmontar pueden ser el alcohol (etanol) o la acetona.
- Ablandar el ejemplar. Se sumerge el ejemplar en agua muy caliente (casi hirviendo) por aproximadamente 5 minutos. Las patas y antenas deben quedar flexibles.
- Separar el abdomen. Bajo el microscopio estereoscópico y con ayuda de dos alfileres, separar el abdomen (hay que insertar un alfiler por detrás de las coxas y presionar. Opcional: en esta etapa se puede aprovechar para sacar antenas, palpos, patas y otras piezas que se necesite examinar.
- Fotografiar el abdomen (opcional). Fotografiar dorsal, en la misma lupa, es importante para que no se confunda. Registrar si hay alguna característica diferenciadora para evitar confusiones cuando se hacen varias genitalias en forma simultanea. De aquí en adelante el insecto y el abdomen van a estar separados, así que deben ser identificados cuidadosamente. También se puede medir y anotar sus medidas para identificarlo posteriormente.
- Remontar el ejemplar. Importante hacerlo en este momento. Hay que remontar junto con la etiqueta y el número de la genitalia (recomiendo siempre montar con goma arábica).
- Ablandar el abdomen. En un tubo de ensayo, 10 gotas de agua destilada con 2-3 escamas, calentar hasta hervir o casi por 4-8 minutos (según tamaño del insecto).
Opcional:También se puede hacer al baño maría (sumergiendo el tubo en agua hirviendo) por 15-20 minutos o bien remojar por 24-48 horas en KOH (3 gotas de agua destilada con una escama de 2x2 mm).
- Disección del abdomen. Para sacar el abdomen del tubo de ensayo se recomienda volcar el contenido completo de esto en un plato blanco. La solución de KOH puede volver a ponerse en el tubo y reutilizar un par de veces.
Bajo el microscopio estereoscópico, poner el abdomen en 2 gotas de agua destilada en vista dorsal.
Con dos alfileres romper la unión de la cutícula dorsal con los ventritos a todo el largo, dejando los genitales al descubierto. El último segmento dorsal es esclerosado, abrirlo cuidadosamente separándolo del ventrito correspondiente. Los segmentos genitales quedan descubiertos: Si es hembra, se saca todo junto: placas coxales, bursa copulatrix, ductos, espermateca, si es macho se separa: tegmen, sifón, etc. Separar también el último segmento dorsal
(el ultimo segmento ventral lo ideal es mantenerlo junto al abdomen, pero a veces se separa).
- Poner en portaobjetos. Los segmentos separados se ponen en una gota de glicerina sobre un portaobjetos (recomiendo sin cubreobjetos: este puede aplastar las piezas, y además cuando se saca es difícil recuperar las piezas).
Nota: al poner el glicerina las piezas pueden doblarse si contienen aire. Hay que volverlas a poner en agua y de ahí devolverlas a la glicerina. Importante: poner el numero de la genitalia en el portaobjeto también.
- Fotografiar. En microscopio con luz trasmitida, con 100x o 200x, para el extremo del sipho 400X. La espermateca debe quedar horizontal. El tegmen hay que fotografiarlo de costado (fácil) y ventral (difícil). Hay que manipularlo hasta que tome la posición correcta, en especial las trabas.
- Montar con el insecto. El montaje se hace con micro frasco (micro vial, Bioquip) y bajo el microscopio estereoscopio. El micro frasco abierto se pone vertical bajo la lupa, con un alfiler se le coloca una gotita de glicerina que cubra una pared, pero que no llene todo el diámetro (importante para evitar problemas de cierre).
Con un alfiler se toman las piezas (una a una) del portaobjetos, y se depositan en la gotita de glicerina del micro frasco. La última es el abdomen.
Para cerrar el micro frasco se introduce en el un alfiler (que no toque las piezas), se pone la tapa y se retira lentamente el alfiler (esto permite sacar el aire)
Se monta el micro frasco con el insecto, atravesando la tapa con el alfiler. Se agrega etiquetea de sexo con indicación del número para poder asociar a futuro la genitalia con las fotografías.
ACLARADO DE GENITALIA
En el caso de que alguna pieza, sea genitalia o abdomen, sea muy oscura y no se distingan bien sus partes al microscopio, se recomienda aclarar del siguiente modo:
- Preparado: En un recipiente hueco (cápsula de porcelana o portaobjetos con concavidad o incluso una cuchara de porcelana) se ponen las piezas a aclarar. Sobre ellas se vierten 3 gotas de KOH preparado (el mismo líquido que sirvió para la genitalia) y otras tantas gotas de agua oxigenada. Pasado un minuto el líquido debe empezar a generar gran cantidad de burbujas.
- Aclarado: La capsula debe revisarse permanentemente bajo el microscopio estereoscópico, para ver el estado de trasparencia de las piezas. Como el líquido está muy lleno de burbujas, hay que buscar las piezas con ayuda de un alfiler. Las piezas deben permanecer hasta que tomen un color castaño claro. Esto puede tomar entre 5 y 30 minutos, dependiendo del color inicial, grosor, etc. Incluso algunas piezas necesitan sacarse antes que otras.
- Limpiado: Una vez extraídas las piezas, se limpian en agua destilada y se sigue con el proceso normal (punto 10 Poner en portaobjetos).
|